Enerji Diyagramı Nedir? (Örneklerle)
Bir enerji diyagramı, bir reaksiyon boyunca gerçekleşen süreci gösteren bir enerji grafiğidir. Enerji diyagramları, orbitallerde elektronik bir konfigürasyonun görselleştirilmesi olarak da tanımlanabilir; her temsil bir ok bulunan bir yörüngenin bir elektronudur.
Örneğin, enerjik bir diyagramda, üstün yöne işaret eden oklar pozitif dönüşlü bir elektronu temsil eder. Buna karşılık, aşağıyı gösteren oklar, negatif dönüşlü bir elektronu temsil etmekten sorumludur.

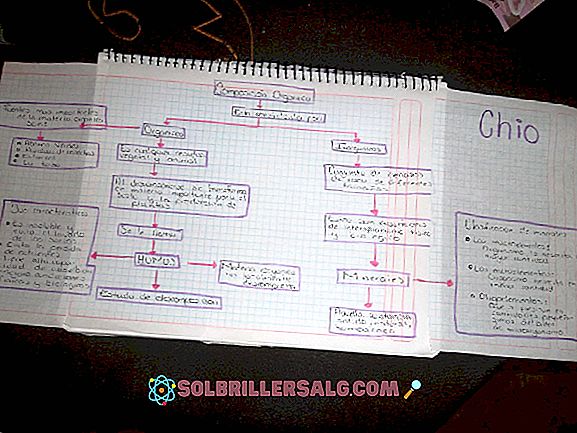
İki tür enerji diyagramı vardır. Bir reaksiyon boyunca üretilen veya harcanan enerji miktarını gösteren termodinamik veya organik kimya diyagramları; elemanlardan başlayarak, ürünlere geçiş halinden geçerek reaktifler.
Ve moleküler orbitalleri atomların sahip olduğu enerji seviyesine göre göstermeye yarayan inorganik kimyanın şemaları.
Enerji diyagramı çeşitleri
Termodinamik diyagramlar
Termodinamik diyagramlar, bir malzemenin (tipik olarak sıvılar) termodinamik durumlarını ve bu malzemenin kullanılmasının sonuçlarını temsil etmek için kullanılan diyagramlardır.
Örneğin, bir kompresörden geçen sıvının davranışını göstermek için bir entropik sıcaklık diyagramı kullanılabilir.

Sankey diyagramı
Sankey diyagramları, okların kalınlığının akış miktarıyla orantılı olarak gösterildiği enerji diyagramlarıdır. Bir örnek şu şekilde gösterilebilir:
Bu şema, bir fabrikanın tüm birincil enerji akışını temsil eder. Bantların kalınlığı, üretim, kullanım ve kayıpların enerjisi ile doğru orantılıdır.
Başlıca enerji kaynakları gaz, elektrik ve kömür / yağdır ve diyagramın sol tarafındaki enerjiyi temsil eder.
Enerji giderlerini, bölgesel veya ulusal düzeydeki malzeme akışını ve bir mal veya hizmetin maliyetinin dökümünü de görebilirsiniz.
Bu şemalar, büyük enerji transferlerine veya bir sistem içindeki akışlara görsel olarak vurgu yapmaktadır.
Genel bir akışta baskın katkıları bulmak söz konusu olduğunda çok faydalıdırlar. Genellikle bu diyagramlar, tanımlanmış bir sistemin sınırları dahilindeki korunmuş miktarları gösterir.
PV diyagramı
Sistemdeki hacim ve basınç ölçümlerine karşılık gelen değişiklikleri tanımlamak için kullanılır. Yaygın olarak termodinamik, kardiyovasküler fizyoloji ve solunum fizyolojisinde kullanılırlar.
PV şemaları başlangıçta gösterge şemaları olarak adlandırıldı. On sekizinci yüzyılda buhar motorlarının verimliliğini anlama araçları olarak geliştirildiler.
Bir PV şeması, bazı işlemlerin veya işlemlerin V hacmine göre P basıncındaki değişimi gösterir.
Termodinamikte, bu işlemler bir döngü oluşturur, böylece döngü tamamlandığında sistemin durumunda herhangi bir değişiklik olmaz; örneğin, ilk basıncına ve hacmine geri dönen bir aparatta olduğu gibi.

Şekil tipik bir PV diyagramının özelliklerini göstermektedir. Bir seri numaralandırılmış durum (1'den 4'e kadar) gözlenebilir.
Her durum arasındaki yol, sistemin (veya her ikisinin) basıncını veya hacmini değiştiren bazı işlemlerden (A'dan D'ye) oluşur.
TS diyagramı
Termodinamikte, termodinamik bir işlem veya döngü sırasında sıcaklıktaki ve spesifik entropideki değişiklikleri görselleştirmek için kullanılır.
Alanda çok yararlı ve çok yaygın bir araç, özellikle bir işlem sırasında ısı transferini görselleştirmeye yardımcı olduğu için.
Tersinir veya ideal işlemler için, bir işlemin TS eğrisi altındaki alan, o işlem sırasında sisteme aktarılan ısıdır.
Bir izentropik işlem, bir TS diyagramında dikey bir çizgi olarak çizilirken, bir izotermal işlem, yatay bir çizgi olarak çizilir.

Bu örnek, sıcak rezervuar sıcaklığında Tc ve soğuk rezervuar sıcaklığında Tc gerçekleşen bir termodinamik çevrimi göstermektedir. Tersinir bir işlemde, kırmızı alan Qc, sistem ile soğuk rezervuar arasında değiştirilen enerji miktarıdır.
Boş alan W, sistem ile onu çevreleyen arasında değiştirilen enerji işinin miktarıdır. Sıcak tank arasında değiştirilen ısı Qh miktarı ikisinin toplamıdır.
Eğer döngü sağa doğru hareket ederse, bunun işi serbest bırakan bir ısı motoru olduğu anlamına gelir. Çevrim ters yönde hareket ederse, iş alan ve Qh sıcaklığını soğuk su deposundan sıcak su deposuna taşıyan bir ısı pompasıdır.
İnorganik kimya diyagramları
Atomlarla ilgili moleküler orbitalleri ve enerji seviyelerini temsil eder veya ana hatları çizer.
Etan potansiyel enerji diyagramı
Etanın farklı şekilleri aynı enerjiye sahip olmayacak, çünkü bunlar hidrojenler arasında farklı bir elektronik itişe sahipler.
Molekül döndükçe, alternatif bir konformasyondan başlayarak, belirli metil gruplarının hidrojen atomları arasındaki mesafe azalmaya başlar. Bu sistemin potansiyel enerjisi, kapalı bir konformasyona ulaşana kadar artacaktır.
Farklı enerji türleri, farklı biçimler arasında grafiksel olarak gösterilebilir. Etan diyagramında, tutturulmuş konformasyonların en fazla enerji miktarı olduğu; Öte yandan, alternatifler minimum olacaktır.
Bu etan potansiyeli enerji diyagramında, tutulumlu bir konformasyondan başlıyoruz. Sonra 360 ° 'ye kadar 60 °' den 60 ° 'ye dönerler.

Farklı konformasyonlar enerjiye göre sınıflandırılabilir. Örneğin, alternatif 1, 3 ve beş aynı enerjiye sahiptir (0). Diğer yandan, 2, 4 ve 6 nolu konformasyonlar, hidrojen gazı tutulmasının bir sonucu olarak daha fazla enerjiye sahip olacaktır.